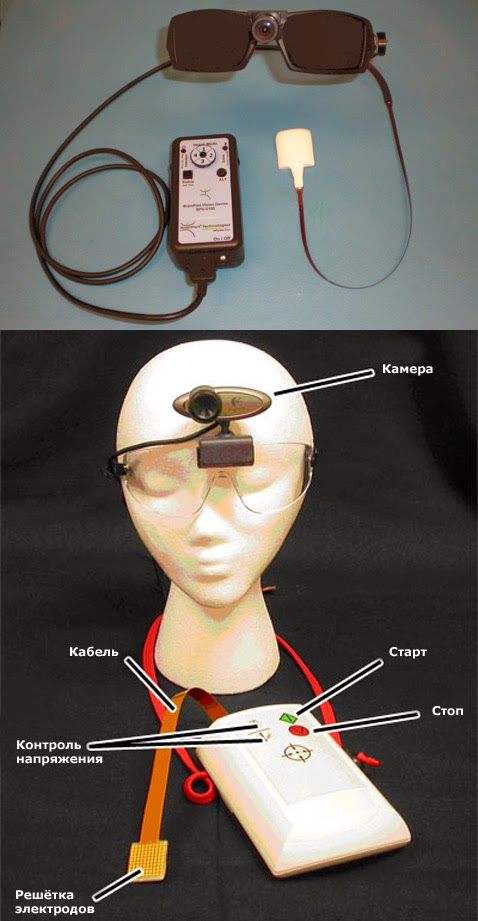
22 сентября 2014 года на ресурсе www.businesswire.com было опубликовано сообщение от компании EBS Technologies об открытии ее первой офтальмологической клинической базы в Германии, предлагающей использование устройства EBS NEXT WAVE™ для стимуляции мозга, способствующее расширению поля зрения пациентов с ослабленным зрением, вызванным глаукомой, инсультом и другими неврологическими заболеваниями.
На официальном сайте компании
EBS Technologies можно найти
описание предлагаемого терапевтического подхода:
Терапия посредством электрической синхронизации мозга (EBS
therapy)
- (англ. Еlectrical brain synchronization (EBS), далее по тексту ЭСМ) представляет собой совершенно новый метод лечения нарушений зрительной системы, имеющих неврологический характер.
- (англ. Еlectrical brain synchronization (EBS), далее по тексту ЭСМ) представляет собой совершенно новый метод лечения нарушений зрительной системы, имеющих неврологический характер.
ЭСМ терапия – это безопасное неинвазивное
электростимуляционное устройство, нацеленное на восстановление выпадений поля зрения (при
которых некоторые объекты на сетчатке глаза не фиксируются и «выпадают» из общего поля зрения), вызванные
неврологическими расстройствами, такими как инсульт, черепно-мозговая травма,
передняя ишемическая оптическая нейропатия, нейропатия зрительного нерва, а
также нескольким видами глаукомы. Общим для вышеперечисленных заболеваний
является повреждение нервных структур в зрительном нерве и/или в тех областях
мозга, которые отвечают за зрительное восприятие с последующим снижением эффективности зрительного восприятия.
В некоторых случаях
функциональность зрительного нерва может быть восстановлена путем спонтанной реорганизации мозга (т.н. эффект
самовосстановления). Тем не менее, большинство из произошедших таким образом функциональных
утрат считаются постоянными.
ЭСМ технология NEXT WAVE™, предполагает использование вызванного током набора электрических импульсов, передающихся пациенту посредством 4-х электродов, размещаемых вокруг
глаз пациента.
Механизм действия
Согласно
теоретико-информационного подхода, вся информация в головном мозге хранится в
виде неврологических сетей. После травмы или из-за конкретных неврологических
заболеваний головного мозга (инсульта или черепно-мозговой травмы;
нервно-офтальмологического заболевания, такого как глаукома), эти сети
повреждаются в разной степени, что может привести к потере функции (напр. к выпадению
полей зрения). Потеря функции происходит не только в результате смерти пораженных
клеток, но также и в результате неактивности выживших клеток, формирующих сеть.
ЭСМ терапия направлена
на улучшение остаточной функции этих сетей посредством реактивации выживших,
но неактивных клеток с последующим повторным включением их в сеть (т.н.
нейро-синхронизация). В дополнение к такому нейро-пластическому эффекту, стимуляция
переменным током оказывает также нейро-защитное действие, улучшающее метаболизм
нервных клеток. Результатом ЭСМ терапии является восстанавление части
функциональных возможностей головного мозга, либо сокращение дальнейшей утраты функции
(напр., при глаукоме).
Во время ЭСМ терапии
происходит стимуляция сетчатки пациента (т.н. ретино-фугальная стимуляция, см. глоссарий) и создается
серия потенциалов действия, передающихся по зрительному нерву в зрительный
центр мозга. Мозг интерпретирует эти сигналы как световые ощущения (фосфены). В
то же время, измерение сигналов электроэнцефалограммы (ЭЭГ) головного мозга позволяет
оптимизировать импульсную последовательность для получения постоянного эффекта
от накопленного опыта.
ЭСМ терапия длится 10 дней и состоит
из 10 сеансов, по 70 минут каждый.
Эффективность ЭСМ терапии была продемонстрирована в рандомизированном, плацебо-контролируемом, и двойном слепом исследовании (см.глоссарий).
Критериями оценки этого исследования служили данные изменения поля зрения пациента, отображающие его пространственное восприятие. Эти изменения были определены и подсчитаны посредством стандартизированных периметрических измерений (измерений поля зрения). При среднем улучшении поля зрения на 24%, данные исследований оказались статистически достоверными.
ЭСМ терапия соответствует основным требованиям директив ЕС и доступна в квалифицированных клинических центрах Германии.
Согласно текущих данных, ЭСМ терапия может
активировать спонтанные процессы пластичности мозга, что может приводить к дальнейшему
улучшению эффективности зрительного восприятия пациента даже после завершения
терапии.
_____________________________________
Глоссарий:
1. В ходе рандомизированного, плацебо-контролируемого исследования, все участники процесса случайным образом разделяются на две группы. Одна группа проходит фактическую терапию, в то время как вторая группа является контрольной и получает плацебо. Двойное слепое означает, что ни участники процесса, ни врачи не знают, кто фактически проходит терапию и кто получает плацебо. При использовании данной процедуры обеспечивается статистически объективная оценка исследования.
2. Ретино-фугальные нервные волокна сообщают глаз с мозгом. Ретино-фугальная стимуляция усиливает раздражение нервных клеток, расположенных в сетчатке с помощью электрических импульсов и / или оптических раздражителей. Они передаются через зрительный нерв и зрительный таламус к зрительной зоне коры головного мозга, находящейся в задней части головы, где происходит обработка изображений головным мозгом.
_____________________________________
Глоссарий:
1. В ходе рандомизированного, плацебо-контролируемого исследования, все участники процесса случайным образом разделяются на две группы. Одна группа проходит фактическую терапию, в то время как вторая группа является контрольной и получает плацебо. Двойное слепое означает, что ни участники процесса, ни врачи не знают, кто фактически проходит терапию и кто получает плацебо. При использовании данной процедуры обеспечивается статистически объективная оценка исследования.
2. Ретино-фугальные нервные волокна сообщают глаз с мозгом. Ретино-фугальная стимуляция усиливает раздражение нервных клеток, расположенных в сетчатке с помощью электрических импульсов и / или оптических раздражителей. Они передаются через зрительный нерв и зрительный таламус к зрительной зоне коры головного мозга, находящейся в задней части головы, где происходит обработка изображений головным мозгом.